Reset-Taste in der Therapie
Larotrectinib – Erwachsene und Kinder Tumorart-unabhängig behandeln
So könnte Krebs in der Zukunft überlistet werden: Die Therapie eines Tumors richtet sich nicht mehr nach dem Entstehungsort im Körper, sondern nach seinem molekularen Fingerabdruck. Der hoch-selektive TRK (Tropomyosin-Rezeptor-Kinase)-Hemmer Larotrectinib (Vitrakvi®) ist Pionier dieser neuen Ära.
Das „small molecule“ Larotrectinib wurde am 19. September von der Europäischen Kommission als erste Tumorart-unabhängige Therapieoption zugelassen. Bei Larotrectinib handelt es sich also nicht nur um eine Therapieoption für eine bestimmte Krebsart, sondern für alle soliden Tumore. Voraussetzung für eine Therapie mit Larotrectinib ist der Nachweis einer bestimmten Mutation, einer NTRK-Genfusion. NTRK steht für neurotrophe Tropomyosin Rezeptorkinase. Es gibt drei NTRK-Gene: NTRK1, NTRK2 und NTRK3, sie codieren entsprechend die TRK-Proteine TRKA, TRKB bzw. TRKC. Ein NTRK-Gen kann ein Onkogen werden, wenn es während der Zellteilung mit einem anderen nicht-verwandten Gen durch nicht-homologe Endverknüpfung fusioniert. Das daraus translatierte TRK-Fusionsprotein ist dauerhaft aktiv und nicht mehr über seine natürlichen Signale steuerbar. Es regt das Wachstum von Zellen und eine unkontrollierte Zellkommunikation an. TRK-Fusionsproteine sind onkogene Treiber für die Entstehung und Ausbreitung von Tumoren bei Patienten mit TRK-Fusionstumoren.[1,2,3] TRK-Fusionstumore sind selten – sie treten jedoch bei vielen verschiedenen Tumorarten mit unterschiedlicher Prävalenz bei Erwachsenen und pädiatrischen Patienten auf.[4] Die Häufigkeit innerhalb einer bestimmten Tumorentität ist sehr unterschiedlich: Während beim infantilen Fibrosarkom 91 bis 100% der Tumore ein NTRK-Fusionsgen [5,6] aufweisen, sind es beim Dickdarmkarzinom lediglich 1%.[7]
Larotrectinib wurde eigens zur Therapie von TRK-Fusionstumoren bei Erwachsenen und pädiatrischen Patienten entwickelt. Der neue Kinase-Hemmer ist in vielerlei Hinsicht bemerkenswert: Larotrectinib zielt als hoch-selektiver TRK-Hemmer spezifisch auf Tumorerkrankungen mit einer NTRK-Genfusion. Er hemmt ausschließlich TRKA, TRKB und TRKC und damit keine anderen Kinasen. Zudem liegt für Larotrectinib der bisher umfangreichste Datensatz mit der längsten Nachbeobachtungsdauer vor, der für einen TRK-Inhibitor verfügbar ist. Die Antitumorwirkung erfolgt unabhängig vom Alter der Patienten, dem Ort der Tumorentstehung im Körper und dem NTRK-Fusionspartner. Larotrectinib hat bei guter Verträglichkeit hohe Ansprechraten bei TRK-Fusionstumoren von pädiatrischen Patienten und Erwachsenen in den klinischen Studien erzielt.[1]
Eingesetzt werden darf VITRAKVI® (Larotrectinib) als Monotherapie bei allen erwachsenen und pädiatrischen Patienten mit soliden Tumoren, bei denen eine NTRK-Genfusion vorliegt. Voraussetzung ist, dass die Patienten eine lokal fortgeschrittene oder metastasierte Erkrankung aufweisen oder eine Erkrankung, bei der eine chirurgische Resektion wahrscheinlich zu schwerer Morbidität führt und für die keine zufriedenstellende Therapieoption zur Verfügung steht. Larotrectinib wird oral verabreicht.[8] Neben den Staaten der EU (Europäischen Union) ist das Arzneimittel bereits in den USA, Brasilien und Kanada sowie vielen weiteren Ländern zugelassen.
Was Larotrectinib kann, zeigt ein beeindruckendes Fallbeispiel: eine junge Frau mit einem Lungentumor in einer palliativen Therapiesituation. Der Pathologe identifiziert bei ihr eine NTRK-Genfusion und ihr Arzt beginnt eine Therapie mit Larotrectinib. Sehen Sie hier die Patientin Kerstin mit ihrem Arzt Dr. Maximilian Hochmair, Krankenhaus – Klinik Florisdorf (Österreich), im Interview.
Larotrectinib – Highlights der Studiendaten
ORR in Primäranalyse bei 72%
Zulassungsrelevant für die EU waren gepoolte klinische Daten von 102 pädiatrischen und adulten Patienten (93 aus der primären Analyse und 9 weitere mit primären ZNS-Tumoren)[3] aus drei Phase I/II-Studien.[9,10,11] Die Gesamtansprechrate (overall response rate, ORR) lag in der Primäranalyse bei 72% [(95%-KI: 62%, 81%) (n=67/93)] – darunter 16% vollständiges Ansprechen (complete response, CR), 1% chirurgische komplette Remission (surgical complete response, sCR) und 55% partielles Ansprechen (partial response, PR). Die mediane Reduktion der Tumorgröße bei den Patienten in der Primäranalyse (n=93) betrug 66%. Bei den pädiatrischen Patienten sprachen insgesamt 82% der Kinder und Jugendlichen auf die Therapie mit Larotrectinib an (n=28). Dass Larotrectinib auch nachweisbar bei ZNS (zentrales Nervensystem) -Tumoren wirkt, zeigt eine zusätzliche Analyse, in die auch die insgesamt 9 Patientinnen mit primären ZNS-Tumoren eingeschlossen wurden (n=102 (93+9)): Die ORR betrug 67% (95%-KI: 57%,76%) – darunter 15% CR und 51% PR.
Larotrectinib wurde eigens zur Therapie von TRK-Fusionstumoren bei Erwachsenen und pädiatrischen Patienten entwickelt. Der neue Kinase-Hemmer ist in vielerlei Hinsicht bemerkenswert: Larotrectinib zielt als hoch-selektiver TRK-Hemmer spezifisch auf Tumorerkrankungen mit einer NTRK-Genfusion. Er hemmt ausschließlich TRKA, TRKB und TRKC und damit keine anderen Kinasen. Zudem liegt für Larotrectinib der bisher umfangreichste Datensatz mit der längsten Nachbeobachtungsdauer vor, der für einen TRK-Inhibitor verfügbar ist. Die Antitumorwirkung erfolgt unabhängig vom Alter der Patienten, dem Ort der Tumorentstehung im Körper und dem NTRK-Fusionspartner. Larotrectinib hat bei guter Verträglichkeit hohe Ansprechraten bei TRK-Fusionstumoren von pädiatrischen Patienten und Erwachsenen in den klinischen Studien erzielt.[1]
Die mediane Zeit bis zum ersten Ansprechen lag bei 1,81 Monaten (Spanne: 0,95-14,55). Nach fast 18 Monaten Nachbeobachtung wurde die mediane Dauer des Ansprechens (duration of response, DOR) noch nicht erreicht (Range: 1,6+ bis 38,7+). 88% der Remissionen hielten 6 Monate oder länger an (n=82). 75% der Remissionen hielten 12 Monate oder länger an (n=70). Nach einem Jahr waren 64% der Patienten ohne Progression.
Larotrectinib wurde sowohl von den pädiatrischen als auch von den erwachsenen Patienten gut vertragen. Es traten kaum unerwünschte Ereignisse vom Schweregrad 3 oder 4 auf. Nur wenige Patienten brachen die Behandlung wegen behandlungsbedingter UEs ab (3%).
Larotrectinib auch länger andauernd wirksam und sicher
In einem zusätzlichen Follow-up erreichte der TRK-Hemmer eine konsistente ORR von 79% (n=153; 95%-KI: 72%, 85%) – davon 16% CR und 63% PR. Das zeigte ein Team um David M Hyman (New York, USA) auf dem Jahrestreffen der European Society for Medical Oncology (ESMO) 2019 in einer fortgeschriebenen Auswertung der gepoolten Daten aus den drei oben erwähnten klinischen Studien mit nunmehr 159 pädiatrischen und erwachsenen Patienten. Dieser integrierte Datensatz umfasste 55 Patienten aus dem Primärdatensatz und 104 Patienten aus dem ergänzenden Datensatz, die zum Datenstichtag, 19.02.2019, ausgewertet wurden.[12]
Mediane Ansprechdauer bei fast 3 Jahren
Die hohe ORR von Larotrectinib wurde durch die überzeugenden Ergebnisse der Parameter mediane Ansprechdauer, medianes progressionsfreies Überleben und medianes Gesamtüberleben bestätigt: Bei den Patienten mit bestätigtem Ansprechen (n=108) konnte ein anhaltendes Ansprechen mit einer medianen Ansprechdauer (duration of response, DOR) von 35,2 Monaten (Range: 1,6+ bis 44,2+; 95% KI: 22,8–NE;) beobachtet werden. Damit wurde eine mediane Ansprechdauer von fast 3 Jahren erreicht, die Studien dauern noch an. Nach einem medianen Follow-up von 11,1 Monaten lag das mediane progressionsfreie Überleben [(progression free survival, PFS), n=159] bei 28,3 Monaten (95%-KI: 22,1-NE). Nach 23 Todesfällen unter 159 Patienten (14%) betrug das mediane Gesamtüberleben (overall survival, OS) nach einer medianen Nachbeobachtung von 13,9 Monaten mit 44,4 Monaten knapp 4 Jahre (95%-KI 36,5-NE). Die Studien dauern weiter an.
Die auf dem ESMO-Kongress 2019 vorgestellten Sicherheitsdaten bilden die Gesamtheit der Sicherheitsdaten zu Larotrectinib bei onkologischen Patienten ab (n=260). Sie bestätigen trotz wachsender Patientenpopulation die in früheren Auswertungen gezeigte gute Verträglichkeit. Die Mehrzahl der gemeldeten behandlungsbedingten unerwünschten Ereignisse (UE) war vom Grad 1 oder 2. Aufgrund von UEs erfolgte bei 8% eine Dosisreduktion und 2% der Patienten brachen die Behandlung ab.
Larotrectinib wirksamer als vorhergehende Therapielinien
In einer weiteren auf dem ESMO-Jahreskongress von Dr. Antoine Italiano (Bordeaux, Frankreich) vorgestellten Analyse [13] erwies sich Larotrectinib als wirksamer als vorhergehende Therapielinien. Der Analyse lag die Berechnung des “Growth modulation index” (GMI) zugrunde. Der GMI vergleicht das progressionsfreie Überleben der aktuellen Therapie (hier Larotrectinib) mit der Zeit bis zur Progression der letzten vorhergehenden Therapielinie der jeweiligen Patienten. Ein in der Literatur vorgeschlagener GMI ≥1,33 wurde als Marker für eine sinnvolle klinische Aktivität herangezogen.
Die in diese Auswertung eingeschlossenen pädiatrischen und adulten Patienten (n=53) stammen ebenfalls aus den drei oben erwähnten klinischen Studien. Die Patienten wurden mindestens 6 Monate lang mit Larotrectinib behandelt (oder hatten es vorzeitig abgesetzt) sowie mindestens eine vorherige Linie einer systemischen Therapie im Rahmen der metastasierten Erkrankung erhalten.
Der mediane GMI (pro Independent Review Committee Bewertung) betrug 2,87 (Spanne: 0,01-48,75). Zwei Drittel der Patienten wiesen einen GMI ≥1,33 auf (66%, n=35). Die Daten zeigen, dass die Behandlung mit VITRAKVI® eine wirksamere Therapie darstellen kann als vorhergehende Therapien. Damit stellt sich die Frage, ob Larotrectinib nicht so früh wie möglich eingesetzt werden sollte.
Larotrectinib wurde an circa 20 Histologien untersucht
Die Tumorart-unabhängige Wirkung von Larotrectinib wurde in klinischen Studien an circa 20 Tumorarten untersucht – darunter Lungen- und Schilddrüsenkrebs, Melanom, gastrointestinale Tumore wie Dickdarm-, Bauchspeicheldrüsenkrebs, Gallengangskarzinome oder Karzinome des Wurmfortsatzes, Sarkome, Tumore des zentralen Nervensystems (Gliome und Glioblastome), sekretorische Speicheldrüsenkarzinome sowie bestimmte pädiatrische Krebserkrankungen (beispielsweise infantiles Fibrosarkom, Weichteilsarkome). Darüber hinaus wurden jetzt auch in den ergänzenden Datensatz Tumorarten wie Prostata- und Leberkrebs aufgenommen, die im primären Datensatz nicht vertreten waren.[12]
Hohe Wirksamkeit von Larotrectinib unabhängig von der Art der Tumorerkrankung
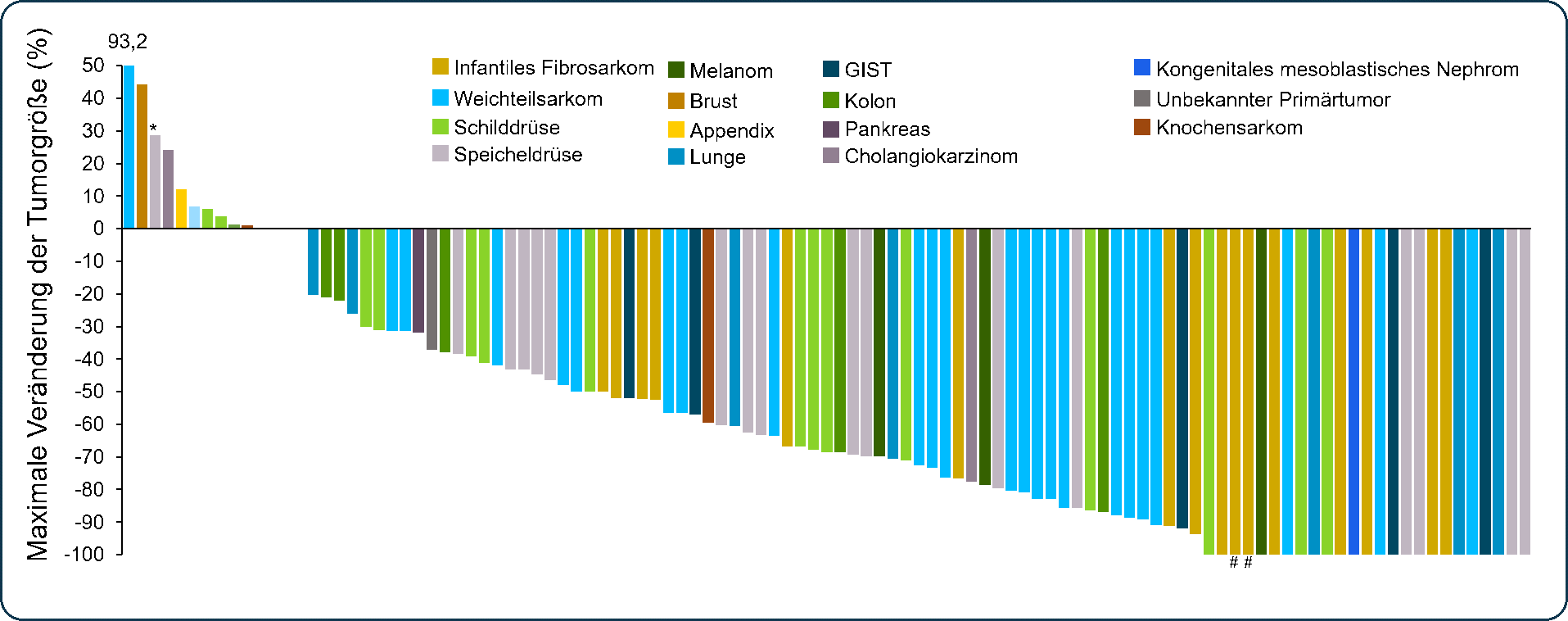
Abb. 1 Beurteilung des Ansprechens durch den Prüfarzt nach RECIST 1.1Beurteilung des Ansprechens durch den Prüfarzt nach RECIST 1.1 (Stand 30. Juli 2018). *Der Patient wies zu Beginn der Studie eine TRKC-Solvent-Front-Resistenzmutation (G623R) aufgrund einer Vortherapie auf; #Chirurgische CR. ; †RECIST 1.1. ‡Einschließlich 9 Fälle einer unbestätigten Teilremission, deren Bestätigung zum Beurteilungszeitpunkt noch ausstand. CR: Complete Response (Komplette Remission); GIST: Gastrointestinaler Stromatumor; ORR: Objective Response Rate (objektive Ansprechrate); PR: Partial Response (Teilremission). Lassen UN, et al. Vorgestellt: ESMO-Kongress 2018, 19.–23. Oktober 2018, München. Abstract 4090
Testung auf eine NTRK-Genfusion – Was die ESMO empfiehlt
Nach Patienten mit einer NTRK-Genfusion muss gezielt gesucht werden; dabei steht der Pathologe im Fokus. Eine Methode, die sich für den Nachweis sehr gut anbietet, ist das NGS (Next Generation Sequencing). Mit dieser sehr genauen Methode der Nukleinsäureanalytik kann eine große Anzahl an Genen gleichzeitig auf Genänderungen untersucht werden – wodurch auch Probenmaterial gespart wird.
Um möglichst viele Tumorpatienten mit einer NTRK-Genfusion zu identifizieren, hat die ESMO aktuelle Empfehlungen für den routinemäßigen klinischen Nachweis dieser Fusionen festgelegt und in einem Positionspapier veröffentlicht. Eine der wichtigsten Aussagen darin: Bei Tumorarten, bei denen NTRK-Genfusionen häufig auftreten, sollten behandelnde Ärzte sofort eine molekulare Diagnostik beim Pathologen veranlassen. Daher sollte bei Patienten, bei denen mit einer Wahrscheinlichkeit von circa 90% und mehr mit einer NTRK-Genfusion zu rechnen ist, eine solche Diagnostik zwingend erfolgen. Bei Tumorarten mit (sehr) seltenen NTRK-Genfusionen sollten Onkologen in Zusammenarbeit mit Pathologen und in Absprache mit den Patienten entscheiden, ob ein Screening auf NTRK-Genfusionen mittels Immunhistochemie (IHC) sinnvoll ist und bei positivem Ergebnis die Diagnose mittels NGS bestätigen.[14]
Abgestuftes Vorgehen bei der Auswahl der Diagnostik-Methoden
Bezüglich der anzuwendenden Diagnostik-Methoden empfiehlt die ESMO ein abgestuftes Vorgehen. Bei Tumorarten, bei denen insbesondere ganz spezifische NTRK-Genfusionen (z. B. NTRK3-ETV6) häufig auftreten bzw. nahezu charakteristisch für den jeweiligen Tumortyp sind, sollte das Tumorgewebe zunächst mittels Immunhistologie und Fluoreszenz-in-situ-Hybridisierung (FISH) orientierend untersucht werden. Reverse-Transkriptase-Polymerase-Kettenreaktion (RT-PCR)-basierte Testsysteme oder NGS sind zur beweisenden Absicherung notwendig.[14]
Nexavar – Highlights mit OS-Rekord
Liegt einem Leberzellkarzinom eine NTRK-Genfusion zugrunde, ist in diesem Fall Larotrectinib (Vitrakvi®) – gemäß Zulassungsvoraussetzungen – das Medikament der Wahl.
Für die systemische Therapie zur Behandlung des hepatozellulären Karzinoms (HCC) steht als zielgerichtete Therapie Sorafenib (Nexavar®) zur Verfügung. Bei Sorafenib handelt es sich um einen bewährten oralen Multi-Kinase-Inhibitor, der gezielt sowohl Tumorzellen als auch Tumorgefäße angreift. Sorafenib blockiert 40 Kinasen – darunter die Aktivität von Rezeptor 2 des vaskulären endothelialen Wachstumsfaktors (VEGF) und das Onkogen B-Raf. Die zielgerichtete Therapie mit dem Multi-Kinase-Inhibitor Sorafenib ist der Goldstandard in der Erstlinientherapie bei Patienten mit einem HCC und guter Leberfunktion sowie einem guten ECOG (Performance-Status der Eastern Cooperative Oncology Group) im Erkrankungsstadium BCLC C und BCLC B – wenn diese nicht mehr für die loko-regionäre Therapie infrage kommen.[15] Seit der Zulassung im Jahr 2007 haben viele HCC-Patienten von dieser Therapie profitiert. Bis dato gab es keine andere zugelassene systemische Firstline-HCC-Therapie.
Sorafenib ist neben dem HCC in der EU für zwei weitere Indikationen zugelassen: Zum einen zur Behandlung von Patienten mit fortgeschrittenem Nierenzellkarzinom, bei denen eine vorherige Interferon-alpha- oder Interleukin-2-basierte Therapie versagt hat oder die für solch eine Therapie nicht geeignet sind. Zudem ist Sorafenib indiziert zur Therapie von Patienten mit progressivem, lokal fortgeschrittenem oder metastasiertem, differenziertem (papillärem/follikulärem/ Hürthle-Zell-) Schilddrüsenkarzinom, welches gegenüber radioaktivem Jod refraktär ist.[16]
TACE-refraktäre Patienten profitieren von Umstellung auf Sorafenib
Die Standardtherapie für HCC-Patienten im intermediären Stadium ist die TACE (transarterielle Chemoembolisation). Die Herausforderung: Bei mehr als jedem dritten Patienten kommt es nach einer TACE zu einer Krankheitsprogression. Eine Arbeitsgruppe um Lin Po-Ting aus Taiwan [17] untersuchte deshalb, ob TACE-refraktäre Patienten von einer Umstellung auf Sorafenib profitieren im Vergleich zu Patienten, bei denen die TACE mit Best Standard of Care (BSC) fortgesetzt wird. Von 2005 bis 2016 wurden insgesamt 656 behandlungs-naive HCC-Patienten eingeschlossen, die im Chang Gung Memorial Hospital, Linkou Medical Center, mit einer TACE behandelt wurden. Basierend auf den Leitlinien der Japanischen Gesellschaft für Hepatologie, definierte die Arbeitsgruppe das Versagen der TACE als Krankheitsprogression nach zwei aufeinanderfolgenden TACE-Behandlungen innerhalb von sechs Monaten.
Die Inzidenz für ein TACE-Versagen betrug 30,8% (n=202) – davon war ein Großteil im BCLC Stadium C oder D (86%). Dabei waren vor allem Patienten mit einem fortgeschrittenen Tumorstadium, hoher Tumorlast und -größe, höheren AFP(Alpha-Fetoprotein)-Ausgangswerten, Fieberschüben nach der ersten TACE-Behandlung anfällig für ein TACE-Versagen. Dieser Zusammenhang ließ sich auch auf Patienten mit ansteigenden AFP-Werten und zunehmenden Child-Pugh-Scores übertragen. Nach Dokumentation des TACE-Versagens wurden die Patienten entweder auf Sorafenib umgestellt (13,4%) oder weiterhin einer TACE mit Best Supportive Care (BSC) unterzogen (78,2%). Nach einem 1:2 Propensity Score Matching (jedem behandelten Patienten werden zwei unbehandelte Patienten zugeteilt) war bei den mit Sorafenib behandelten Patienten das mOS signifikant 7,5 Monate länger als in der Kontrollgruppe [20,8 (14,4-27,2) Monate vs. 13,3 (10,8-15,8) Monate, p=0,038].
Sorafenib erreichte längstes dokumentiertes OS: 14,7 Monate
Auf dem Jahrestreffen der European Society for Medical Oncology (ESMO) 2019 punktete Sorafenib mit einem Rekord: Es erzielt das längste bisher dokumentierte OS. Hinzu kommt: Der Multikinase-Inhibitor konnte gegenüber dem monoklonalen Antikörpers Nivolumab Punktsiege erzielen.
In der randomisierten, multizentrischen Phase-III-Studie CheckMate-459 (CheckMate-459: CHECKpoint Pathway und klinische Prüfung mit Nivolumab 459) wurde die Überlegenheit von Nivolumab gegenüber Sorafenib geprüft. Es handelt sich dabei um eine immuntherapeutische Untersuchung von Nivolumab im Vergleich zu Sorafenib als Erstlinientherapie bei Patienten mit fortgeschrittenem hepatozellulärem Karzinom.[18]
In die CheckMate-459 eingeschlossen wurden erwachsene Patienten mit einem histologisch bestätigten fortgeschrittenen HCC, das weder für eine chirurgische Resektion und/oder lokale Therapie geeignet war; oder Patienten, deren Erkrankung nach einer Operation und/oder einer lokalen Therapie eine Progression zeigte (n=743). Die Patienten mussten einen Child-Pugh A sowie einen guten Allgemeinzustand mit einem ECOG Performance Status 0-1 aufweisen und durften bisher noch keine systemische Therapie erhalten haben. Das Team um Studienautor Thomas Yau (University of Hong Kong, Hong Kong, China) randomisierte die Patienten zwischen Januar 2016 und Mai 2017 für die Erstlinientherapie gleichmäßig auf Nivolumab (n=371, 240mg IV, Q2W) oder Sorafenib (n=372, 400mg oral, 2-mal täglich).
Highlight der auf dem ESMO für Sorafenib präsentierten Daten war, dass der Multi-Kinase-Inhibitor jetzt das längste in einer Phase-III-Studie dokumentierte Intervall des medianen Gesamtüberlebens (overall survival, OS) mit 14,7 Monaten erreichte. Die Studienlandschaft (13 randomisierte Phase-III-Studien) zu Sorafenib zeigt einen kontinuierlichen Trend zu einem längeren Gesamtüberleben unter Sorafenib mit einer Verlängerung von 44% oder 4,5 Monaten bezogen auf den Durchschnitt von 10,2 Monaten der 13 aufgeführten Studien.(Abb. 2).
Kontinuierlicher Trend zu einem längeren Gesamtüberleben über die Zeit
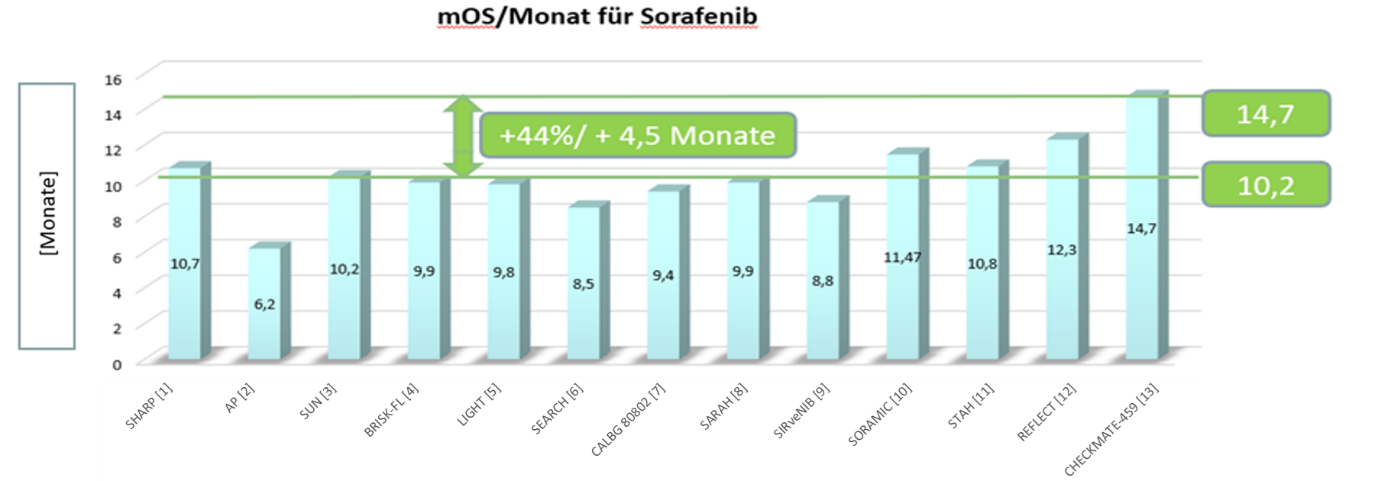
Abb. 2; Quellen: Adaptiert nach ESMO 2019: Proffered Paper 1 - Gastrointestinal tumours, non-colorectal; CheckMate 459: A randomized, multi-center phase III study of nivolumab (NIVO) vs sorafenib (SOR) as first-line (1L) treatment in patients (pts) with advanced hepatocellular carcinoma (aHCC) (ID 6572) Diskutant: Arndt Vogel, Hannover Germany; SHARP [1]: Llovet J et al., N Engl J Med 2008, 359:378–90; AP [2] (Asia Pacific): Cheng AL et al., Lancet Oncol 2009, 10:25–34; SUN [3]: Cheng AL et al., J Clin Oncol 2013, 31:4067–75; BRISK-FL 4: Johnson PJ et al., J Clin Oncol 2013, 31:3517–24; LIGHT [5]: Cainap C et al., J Clin Oncol 2015, 33:172–9; SEARCH [6]: Zhu AX et al., J Clin Oncol 2015, 33:559–66; CALBG 80802 [7]: Ghassan K. Abou-Alfa et al., JAMAOncology, September 5, 2019; https://jamanetwork.com/ by a Bayer HealthCare AG User on 09/30/2019; SARAH [8]: Vilgrain V et al., Lancet Oncol 2017, 18:1624–36; SIRveNIB [9]: Chow PKH et al., J Clin Oncol 2018, 36:1913–21; SORAMIC [10]: Ricke J et al., Ann Oncol 2018, 29 (Suppl 5):O-029; STAH [11]: Joong-Won Park et al., Journal of Hepatology 2019 vol. 70 j 684–691; http://creativecommons.org/licenses/by-nc-nd/4.0/; REFLECT [12]: Kudo M et al., Lancet 2018, 391:1163–73; CheckMate-459 [13] CheckMate-459: A Randomized, Multi-Center Phase 3 Study of Nivolumab vs Sorafenib as First-Line Treatment in Patients With Advanced Hepatocellular Carcinoma. Vorgestellt: ESMO, 27.9-1.10. 2019, Barcelona, Spanien. Abstract Nummer 6572.
Das mediane OS lag für Nivolumab bei 16,4 Monaten (Spanne: 13,9-18,4) und für Sorafenib bei 14,7 Monaten (Spanne: 11,9-17,2; Hazard Ratio (HR) 0,85; 95%-KI: 0,72-1,02; p=0,0752]. Dieses Ergebnis verfehlte die festgelegte Schwelle der statistischen Signifikanz für das OS, obwohl Nivolumab einen klinischen Nutzen zeigte. Nach 12 Monaten waren in der Nivolumab-Gruppe 60% der Patienten am Leben, in der Sorafenib-Gruppe 55%, nach 24 Monaten lagen die OS-Raten entsprechend bei 37% bzw. 33%.
Bezüglich der Folgetherapien ergab sich folgendes Bild: In der Sorafenib-Gruppe bekamen numerisch mehr Patienten irgendeine Folgetherapie im Vergleich zur Nivolumab-Gruppe (n=196, 53%, vs. n=181, 49%,). Dabei erhielten 140 Patienten (38%) im Nivolumab-Arm und 170 Patienten (46%) im Sorafenib-Arm eine anschließende systemische Therapie.
Die Ergebnisse der CheckMate-459-Studie werfen zudem die Frage auf, ob diese Daten den aktuellen Therapiestandard beeinflussen werden.
Patienten profitieren von Sorafenib-Regorafenib-Sequenztherapie
Für HCC-Patienten, die unter Sorafenib einen Progress erfahren, ist seit August 2017 für die Zweitlinientherapie der Multi-Kinase-Inhibitor Regorafenib (Stivarga®) zugelassen. In der Phase-III-Studie RESORCE war Regorafenib gegenüber Placebo in Bezug auf das mediane OS signifikant überlegen.[19] Eine gepoolte Analyse zeigte, dass Patienten, die die Sequenztherapie Sorafenib-Regorafenib durchliefen, ein medianes OS von 26 Monaten erreichen konnten.[20]* In der RESORCE-Studie wurden allerdings die zum Therapiebeginn mit Sorafenib vorliegenden klinischen Daten nicht erfasst. Daher sollte der klinische Benefit der Sorafenib-Regorafenib-Sequenztherapie anhand von Real-Life-Daten bestätigt werden: Ein Team um Sae Yumita, Japan untersuchte in einer retrospektiven Studie die Effekte der Sorafenib-Regorafenib-Sequenztherapie ab dem ersten Therapietag mit Sorafenib in Patienten mit fortgeschrittenem HCC.[21] Die Studienpopulation umfasste 319 Patienten mit Child-Pugh A, ECOG-PS≤1 und einer Tagesdosis Sorafenib ≥400 mg. Ein Großteil der Patienten (89%) begann die Sorafenib-Therapie mit einer Volldosierung von 800 mg.
*Das mediane Gesamtüberleben ab Beginn der Erstlinientherapie mit Sorafenib bis zum Tod innerhalb der Beobachtungszeit der RESORCE-Studie wurde kalkuliert aus der Behandlungsdauer der Erstlinientherapie mit Sorafenib, der Dauer der Screeningphase für die RESORCE-Studie (bis zu 10 Wochen) sowie dem medianen Gesamtüberleben innerhalb der RESORCE-Studie.
Laut Ergebnis profitieren Patienten mit fortgeschrittenem HCC von der Sorafenib-Regorafenib-Sequenztherapie, wenn die Daten ab dem ersten Tag der Sorafenib-Therapie in die Analyse einbezogen wurden. So hatten Patienten, die die Sorafenib-Regorafenib-Sequenztherapie erhielten, einen OS-Median von 27,1 Monaten (95%-KI 22,5-31,7), während Patienten, die zwar Kandidaten für Regorafenib gewesen wären, aber nicht umgestellt wurden, einen signifikant kürzeren OS-Median von 15,1 Monaten (95%-KI 12,-17,6) aufwiesen (p=0,006). Die Analyse zeigt allerdings auch, dass lediglich eine begrenzte Anzahl von Patienten (weniger als 10%) die Sequenztherapie erhalten konnte. Daher plädieren die Studienautoren dafür, dass mehr Patienten mit fortgeschrittenem HCC, die unter Sorafenib progredient werden, auf Regorafenib (Stivarga®) umgestellt werden sollten.
In den multivariaten Analysen waren eine Behandlung mit Regorafenib nach Sorafenib und eine Zeitspanne bis zum Versagen der Sorafenib-Therapie (TTP) von mehr als 3,8 Monaten positive OS-Prädikatoren, während sich unter anderem keine Therapie mit Regorafenib als negative unabhängige Vorhersagevariable für das OS erwies.
Sorafenib kann sich gegenüber Pembrolizumab behaupten
Da das HCC oft mit Entzündungen und einem supprimierten Immunsystem assoziiert ist, galten Checkpoint-Inhibitoren als neue Hoffnungsträger bei der fortgeschrittenen Erkrankung. Der Checkpoint-Inhibitor Pembrolizumab (Pembro) erhielt auf Basis der Ergebnisse zu den Antitumoreffekten und des handhabbaren Sicherheitsprofils der Phase-II-Studie KEYNOTE-224 (Pembro in Patienten mit fortgeschrittenem HCC im Anschluss an eine Therapie mit Sorafenib) ein beschleunigtes Zulassungsverfahren von der FDA.[22] Ein Team um Richard S Finn, Santa Monica, USA, untersuchte dann jedoch in der KEYNOTE-240 (NCT02702401) – einer randomisierten Placebo-kontrollierten Phase-III-Studie – Pembrolizumab gegenüber Placebo bei Patienten mit fortgeschrittenem HCC, die in der Erstlinie Sorafenib erhalten hatten.[23] Eingeschlossen wurden 413 Patienten mit radiologischer oder histopathologischer HCC-Diagnostik im BCLC Stadium-B/C, die eine vorangegangene Therapie mit Sorafenib wegen Tumorprogress oder Intoleranz abgebrochen hatten.
Obwohl sich unter Pembro das OS gegenüber Placebo verbesserte, erreichte die Differenz die zuvor definierte Effektivitätsgrenze nicht (HR 0,781, mOS: 13,9 vs. 10,6 Monate, einseitiger Test p=0,0238). Auch mit Blick auf das PFS wurde die vorher festgelegte Effektivitätsgrenze nicht erreicht (HR 0,718, mPFS: Pembro: 3,0 vs. Placebo: 2,8 Monate, einseitiger Test p=0,0022). Dagegen verbesserte sich die objektive Ansprechrate bei den mit Pembro behandelten Patienten gegenüber der Kontroll-Gruppe signifikant: mORR-Median 18,3 Monate (14,0-23,4) vs. 4,4 Monate (1,6-9,4; nominal einseitiger Test p=0,00007).
Es fällt auf, dass in beiden Studien-Armen mehr als 40% der Patienten (Pembro: 42%; Placebo: 47%) eine Behandlungsoption in einer weiteren Therapielinie erhielten – ein Aspekt, der die Relevanz eines frühen Wechsels von einer loko-regionären Therapie auf eine systemische Therapie betont. Auf diese Weise können sowohl die funktionelle Reserve der Leber aufrechterhalten als auch möglichst viele Therapielinien erreicht werden.
Highlight der auf dem ESMO für Sorafenib präsentierten Daten war, dass der Multi-Kinase-Inhibitor jetzt das längste in einer Phase-III-Studie dokumentierte Intervall des medianen Gesamtüberlebens (overall survival, OS) mit 14,7 Monaten erreichte. Die Studienlandschaft (13 randomisierte Phase-III-Studien) zu Sorafenib zeigt einen kontinuierlichen Trend zu einem längeren Gesamtüberleben unter Sorafenib mit einer Verlängerung von 44% oder 4,5 Monaten bezogen auf den Durchschnitt von 10,2 Monaten der 13 aufgeführten Studien.(Abb. 2).

